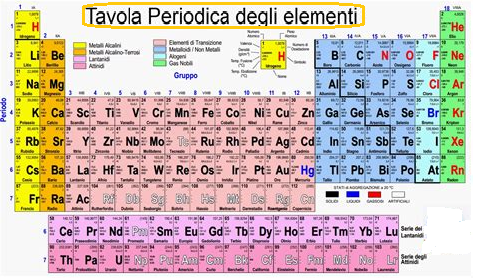
La tavola periodica fu creata grazie ad un chimico russo che riuscì a classificare gli elementi, infatti aveva notato che le proprietà chimiche e fisiche degli elementi si ripetevano in modo periodico e quindi ordinò gli atomi in base alle loro masse atomiche crescenti.
Nella tavola periodica attuale invece gli elementi sono ordinati secondo il numero atomico crescente.
Gli elementi in natura sono 89 a cui si sommano un’altra ventina che sono stati creati in laboratorio, sono indicati con la lettera o le due lettere iniziali del simbolo chimico in latino e sono tutti riportati sulla tavola.
Gli elementi chimici sono ordinati in sette righe orizzontali, chiamate periodi e indicate con i numeri e in un certo numero di colonne verticali, chiamate gruppi, indicati con i numeri romani.
Gli elementi che appartengono allo stesso gruppo hanno caratteristiche chimiche simili. Tutti i periodi iniziano con elementi che hanno un solo elettrone nel guscio esterno e finiscono con elementi che hanno il guscio con otto elettroni.
Inoltre, gli elementi della tavola periodica sono anche divisi in metalli, non metalli, semimetalli e gas nobili.
Gli unici che non possono reagire con altri elementi sono i gas nobili per hanno il guscio più esterno completo e cioè formato da 8 elettroni.
Il primo posto è occupato dall’idrogeno (H) il cui numero atomico (Z) è 1. Esso è l’elemento più presente nell’universo ma si trova poco da solo, quindi è soprattutto legato con altri elementi. Al secondo posto c’è l’elio (He) il cui Z è 2; esso è un gas nobile ed è chimicamente stabile perchè ha un solo guscio elettronico che è completo. Poi con il crescere del numero atomico nel secondo periodo troviamo il Litio (Li), Berilio (Be), il boro (B), il carbonio (C), l’azoto (N), l’ossigeno (O), il fluoro (F) e il neon (Ne). Gli elettroni del guscio più esterno vada da 1 a 8.
Di questi citati consideriamo soprattutto il carbonio, l’ossigeno e l’azoto che sono quelli fondamentali insieme all’idrogeno per la vita. Questi atomi per diventare stabili devono completare gli otto elettroni del guscio esterno e per fare ciò devono condividere con altri atomi i loro elettroni esterni.
In particolare il carbonio ha bisogno di 4 elettroni cioè ha quattro valenze e si dice tetravalente, l’azoto ha 3 valenze e quindi si chiama trivalente, invece l’ossigeno ne ha 2 e si dice bivalente.
Questa situazione vale per tutti gli elementi escluso i gas nobili, per questo la maggior parte delle sostanze che troviamo in natura è un composto.
Se un atomo si unisce con atomi uguali si chiama molecola come ,
ecc.
Continuando troviamo il sodio (Ma), magnesio (Mg), alluminio (Al), silicio (Si) , fosforo (P), zolfo (S), cloro (Cl) e argon (Ar). Il silicio è l’elemento più comune nella crosta terrestre dopo l’ossigeno.