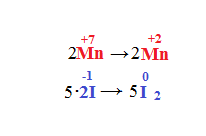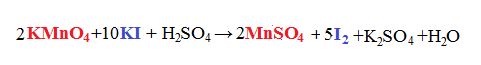Nelle reazioni redox bisogna determinare i coefficienti . Se conosciamo già il numero di ossidazione , si può utilizzare il metodo della variazione del numero di ossidazione.
Molte reazioni avvengono in soluzione acquosa e in questo caso la strategia da seguire è quella del metodo ionico-elettronico che permette di conoscere già prima il numero di molecole di acqua, ioni necessari alla reazione.
METODO DELLA VARIAZIONE DEL NUMERO DI OSSIDAZIONE
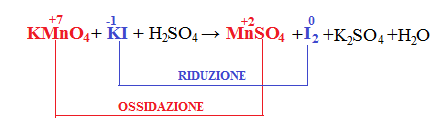
Con questo tipo di metodo la prima cosa da capire effettuando il conteggio dei numeri di ossidazione è capire qual è la specie che si riduce e quale quella che si ossida e si scrivono separatamente le due reazioni come se fossero due semireazioni.
Vediamo un esempio che ci permette di capire ciò che è stato appena detto:
Mn è passato da +7 a +2 e quindi vuol dire che il manganese si riduce.
I passa da -1 a 0, quindi lo iodio si ossida.
Poi se c’è bisogno bisogna bilanciare anche gli atomi da una parte all’altra della freccia, nel caso del nostro esempio bisogna aggiungere solo il 2 allo iodio.
Quindi se consideriamo le due semireazioni:
A questo punto facciamo in modo di far coincidere le due variazioni, nel manganese è -5 e nello iodio +2 quindi dovremo moltiplicare il 2 per il 5, quindi il risultato è 10. Però per il manganese sarà -10, invece per lo iodio +10. A questo punto riportiamo i coefficienti trovati davanti ai rispettivi elementi e otteniamo:
I coefficienti ritrovati li possiamo riportare nella reazione da cui eravamo partiti che non era ancora bilanciata:
A questo punto svolgiamo il bilanciamento di una reazione classica e otteniamo: