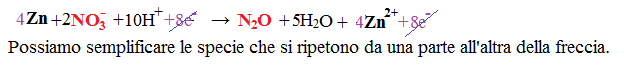Per bilanciare una reazione redox con il metodo ionico-elettronico bisogna fare prima una distinzione e capire se tale reazione avviene in ambiente acido o in ambiente basico. Tale metodo viene usato quando la reazione avviene in soluzione acquosa e coinvolge molecole come acqua oppure ioni quindi sono scritte in forma ionica netta.
REAZIONE IN AMBIENTE ACIDO
Consideriamo la seguente reazione che avviene in ambiente acido:
A questo punto separiamo le due semireazioni, cioè quella che si ossida da quella che si riduce, per fare ciò studiando i numeri di ossidazione lo possiamo capire.
A questo punto bilanciamo gli atomi che si ossidano e quelli che si riducono nelle due semireazioni:
Per bilanciare gli atomi di ossigeno aggiungiamo delle molecole di acqua. Quindi visto che a destra ce n’è sono 6 e a sinistra uno, vuol dire che a sinistra dobbiamo aggiungere 5 molecole di acqua.
Una volta bilanciato l’ossigeno dobbiamo bilanciare l’idrogeno aggiungendo ioni . Notiamo che a destra non ce n’è sono e a sinistra ce n’è sono 10 , quindi dobbiamo aggiungere 10
.
Dobbiamo ora bilanciare la carica elettrica la cui somma deve essere zero sia a destra che a sinistra. Per fare ciò aggiungiamo elettroni a entrambe le semireazioni:
Riuniamo le due semireazioni:
Una volta terminati tutti i passaggi ricontrolliamo se ci troviamo con il bilanciamento di ogni cosa.
In ambiente basico il procedimento è lo stesso, però invece di bilanciare l’ossigeno e l’idrogeno con gli ioni , si aggiungono gli ioni
e molecole di acqua.
E’ sempre però più conveniente bilanciare come se la reazione avvenisse in ambiente acido. Alla fine , si trasformano gli ioni , in molecole di acqua, aggiungendo un pari numero di ioni
,lo stesso numero di tali ioni deve essere riportato anche dalla parte opposta della freccia.
Per capire quello appena scritto possiamo considerare l’esempio dell’acqua ossigenata:
Facciamo un altro esempio in ambiente basico, che poi in fin dei conti serve anche per esercitarsi in ambiente acido, perchè solo il passaggio finale è diverso.
←Pagina
Vedi programma di chimica