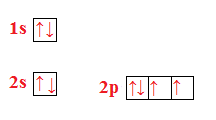
Esercizio n° 1
Qual è la configurazione elettronica dello iodio, che ha numero atomico 53?
Esercizio n° 2
Qual è la configurazione elettronica dell’arsenico (As)?
Esercizio n° 3
Qual è la configurazione elettronica dello ione calcio () e del fluoro(
) e rappresenta l’ordine di riempimento degli orbitali.
Esercizio n° 4
Scrivi la configurazione elettronica del silicio (Si con Z=14) e rappresenta l’ordine di riempimento degli orbitali.
Esercizio n° 5
Scrivi la configurazione elettronica e rappresenta l’ordine di riempimento degli orbitali di ossigeno, zolfo e selenio. Cosa hanno in comune le configurazioni elettroniche di questi elementi?
Esercizio n°6
A quale atomo neutro corrisponde la seguente configurazione elettronica: ?
Esercizio n° 7
Scrivi la configurazione elettronica dei seguenti ioni: ;
.
Esercizio n° 8
Individua tra le seguenti configurazioni esterne quelle dello stato fondamentale e quelle di stato eccitato.
a) ; b)
c)
d)
e)
f)
SVOLGIMENTO
Esercizio n° 1
Qual è la configurazione elettronica dello iodio, che ha numero atomico 53?
Per non sbagliarci basta ricordarci che sulla tavola periodica c’è la configurazione elettronica esterna di ogni elemento.
L’esercizio ci dà il numero atomico Z che ci indica il numero di elettroni che l’elemento presenta.
La sua configurazione sarà, guardando la tavola periodica, o anche senza ma riempendo pian piano i vari orbitali:
Se andiamo a contare gli elettroni notiamo che sono proprio 53 e quindi non ci siamo sbagliati.
Esercizio n° 2
Qual è la configurazione elettronica dell’arsenico (As)?
Esercizio n° 3
Qual è la configurazione elettronica dello ione calcio () e del fluoro (
) e rappresenta l’ordine di riempimento degli orbitali.
Nel caso della configurazione elettronica di ioni si trova sulla tavola periodica l’elemento neutro e per stabilire il numero di elettroni, se è uno ione positivo si toglierà uno o più elettroni all’elemento, se è negativo si aggiungerà uno o più elettroni.
Il primo ione è , poichè è positivo, significa che avrà perso due elettroni; visto che il numero di elettroni del calcio neutro è 20, ma visto che ne ha persi due ci saranno 18 elettroni. Quindi la configurazione elettronica di
è:
Il secondo ione è , lui invece ha acquistato un elettrone e il numero degli elettroni dell’elemento fluoro neutro è 9, avendone acquistato uno, ne diventeranno 10. La sua configurazione è:
.
Esercizio n° 4
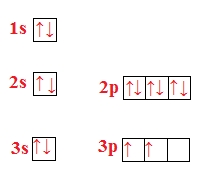
Scrivi la configurazione elettronica del silicio (Si con Z=14) e rappresenta l’ordine di riempimento degli orbitali.
La configurazione del silicio è: .
L’ordine di riempimento è:
Esercizio n° 5
Scrivi la configurazione elettronica e rappresenta l’ordine di riempimento degli orbitali di ossigeno, zolfo e selenio. Cosa hanno in comune le configurazioni elettroniche di questi elementi?
Ossigeno (O)
Zolfo (S)
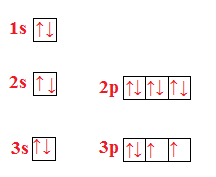
Selenio (Se)
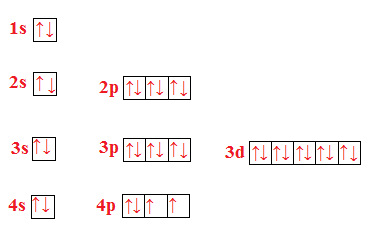
Questi tre elementi hanno in comune il fatto di appartenere tutti allo stesso gruppo e sono tutti gas.
Esercizio n°6
A quale atomo neutro corrisponde la seguente configurazione elettronica: ?
Il germanio
Esercizio n° 7
Scrivi la configurazione elettronica dei seguenti ioni:;
.
In questo esercizio ci sono uno ione negativo e uno positivo, il promo ha acquistato due elettroni e il secondo ne ha ceduti 3.
: l’ossigeno neutro ha un numero atomico, quindi un numero di elettroni pari a 8. Invece lo ione dell’esercizio ha acquistato anche due elettroni quindi avrà 10 elettroni. La configurazione sarà:
.
: L’alluminio neutro ha numero atomico pari a 13, quindi ha 13 elettroni, nel caso dello ione poichè ne ha persi 3 ne avrà 10. L a configurazione sarà:
Esercizio n° 8
Individua tra le seguenti configurazioni esterne quelle dello stato fondamentale e quelle di stato eccitato.
a) ; b)
c)
d)
e)
f)
a) tale elemento è lo zinco e si trova allo stato eccitato perchè lo stato fondamentale è
:
b) è il Kripton che è eccitato perchè normalmente ha come configurazione eterna:
c) è lo stronzio allo stato eccitato, la sua configurazione allo stato fondamentale è:
d) è il gallio allo stato fondamentale
e) è il bromo allo stato fondamentale
f) è il rame allo stato eccitato la cui configurazione dello stato fondamentale è: