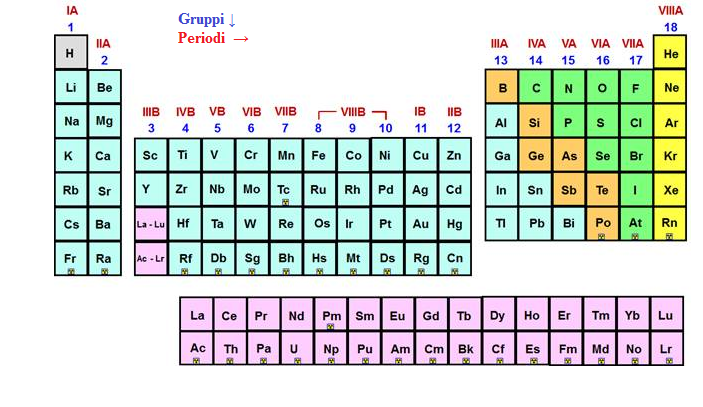
Nella tavola periodica abbiamo detto che secondo la legge della periodicità su cui si basa la tavola periodica, le proprietà chimiche e fisiche degli elementi sono una funzione periodica del loro numero atomico.
Nel sistema periodico si distinguono periodi e gruppi, i periodi sono le righe orizzontali, invece i gruppo quelle verticali.
I periodi
Nei periodi le proprietà fisiche e chimiche variano all’aumentare del numero atomico. Essi sono 7 , i primi tre , detti periodi brevi, contengono solo elementi i cui elettroni sono posti negli orbitali s e p. I periodi dal quarto al settimo sono detti periodi lunghi e contengono elementi con elettroni posti negli orbitali s,p,d e f ; nel sesto e enl settimo periodi si includono anche gli elementi di transizione .
Gli elementi che chiudono i periodi sono i gas nobili che sono sei: elio (He, neon (Ne), argon (Ar), cripton (Kr), xenon (Xe) e radon (Rn). Essi hanno la particolarità di essere per nulla reattivi a causa della loro configurazione elettronica.
I gruppi
I gruppi sono le colonne verticali in cui si trovano elementi che hanno proprietà chimiche simili. I gruppi sono 16 e sono indicati con i numeri romani e sono divisi in otto gruppi A e otto gruppi B , il cui numero romano indica il numero massimo di elettroni del livello energetico esterno che ogni elemento può impegnare nella formazione dei legami.
I gruppi A appartengono ai blocchi s e p e comprendono gli elementi principali. Al I appartengono gli elementi alcalini, al secondo gli alcalino-terrosi, al IV appartengono i calcogeni, al VII gli alogeni e all’VIII i gas nobili.
I gruppi B appartengono al blocco d e comprende gli elementi di transizione; questi hanno una numerazione particolare perchè si inizia da IIIB e si arriva fino a VII B. Quelli appartenenti al gruppo VIII B hanno un comportamenti chimico molto particolare per cui sono stati inseriti in un unico gruppo; gli ultimi due gruppi, poicheè hanno delle analogie con i gruppi IA e IIA allora vengono contrassegnati con la notazione IB e IIB.
Elementi di uno stesso gruppo poichè hanno la stessa configurazione esterna, hanno proprietà chimiche simili.
L’elio è particolare perchè anche se fa parte del gruppo II A non ha le stesse proprietà chimiche di quel gruppo, ma è un gas nobile quindi ha le stesse proprietà chimiche del gruppo VIII A.
Vedi programma di chimica