Le forze intermolecolari sono forze di natura elettrostatica che mantengono le molecole vicine tra loro. Fra le molecole c’è spazio vuoto.
Tali forze possono essere:
- le forze dipolo-dipolo;
- le forze di van der Waals, dette anche forze di London;
- il legame a idrogeno.
Tali legami elettrostatici hanno energia di legame inferiore rispetto al legame covalente e ionico, infatti, sono dette interazioni deboli. Esse però sono importanti nel determinare le proprietà fisiche di sostanze allo stato liquido o solido.
Il legame a idrogeno
Il legame a idrogeno è una forza attrattiva che si stabilisce tra molecole polari che contengono un atomo di idrogeno legato covalentemente a un atomo piccolo, molto elettronegativo e con una o più coppie elettroniche libere, come ossigeno, fluoro e azoto.
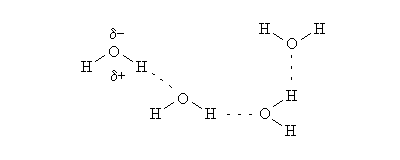
Il legame a idrogeno si può dire che sia una particolare forma d’interazione dipolo-dipolo. L’esempio più lampante è quello della molecola d’acqua . A causa della differente elettronegatività l’ossigeno dell’acqua possiede una parziale carica negativa e i due idrogeni una parziale carica positiva. Questo è il motivo per cui ogni atomo di idrogeno è attratto dall’atomo di ossigeno di una molecola vicina. Questa interazione che si stabilisce è proprio il legame a idrogeno. Per distinguerlo dal legame covalente si usa una linea tratteggiata.
Per esempio questa è la rappresentazione del legame a idrogeno per l’acqua.
Ovviamente questo legame non si forma solo tra molecole di acqua , ma si formeranno in molte molecole, come anche nel fluoruro di idrogeno (HF) , tra le molecole di ammoniaca ().
Il legame a idrogeno è la forza intermolecolare più intensa, ma sempre molto più debole del legame covalente.
Tale legame si può formare anche tra molecole di composti diversi come tra l’alcol etilico e l’acqua.
Questo tipo di legame è presente nelle molecole fondamentali dei viventi come proteine e DNA.
Vedi programma di chimica