In ogni atomo gli elettroni sono distribuiti nei vari orbitali. Essi nel riempire gli orbitali seguono delle regole ben precise:
- gli elettroni tendono ad occupare gli orbitali di minore energia secondo l’ordine di livelli energetici crescenti;
- due elettroni nello stesso orbitale non possono avere i numeri quantici uguali (principio di esclusione di Pauli);
- gli elettroni di un atomo con orbitali degeneri, si dispongono con spin parallelo occupando il maggior numero di orbitali (regola di Hund).
La configurazione elettronica degli atomi è la disposizione degli elettroni nei vari orbitali nel loro stato fondamentale. Quindi è l’insieme degli orbitali necessari per descrivere l’atomo.
La configurazione elettronica la si può rappresentare con i quadratini o con i simboli s,p,d,f.
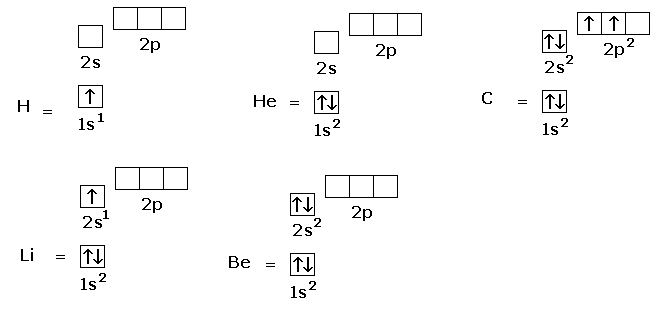
Vediamo alcuni esempi
Nell’immagine precedente vediamo come ogni orbitale sia rappresentato da due numeri e una lettera, analizziamoli:
l’uno che precede la lettera s indica il valore del numero quantico principale, la lettera s corrisponde al numero quantico secondario l, il numero 1 posto dopo la s indica il numero di elettroni presenti nel sottolivello energetico.
Quindi dallo schema vediamo come l’idrogeno abbia un solo elettrone, l’elio ne ha due che saranno disposti nel quadratino con spin opposti, l’atomo di litio avrà tre elettroni, di cui due nell’orbitale minore, cioè 1s e uno nell’orbitale 2s; il berilio ha 4 elettroni, i primi due nell’orbitale 1s e gli altri due nell’orbitale 2s e così via.
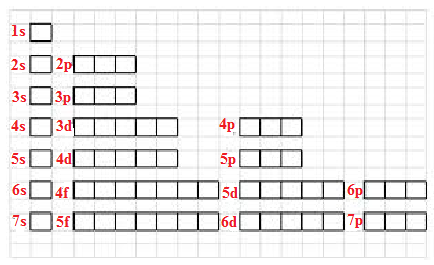
La particolarità subentra partendo dall’orbitale 4s perchè dopo di esso si passa all’orbitale 3d e di nuovo a quello 4d, come si vede nell’immagine di sotto,
Questa configurazione diversa è dovuta al fatto che il sottolivello 4s ha energia inferiore rispetto al 4d
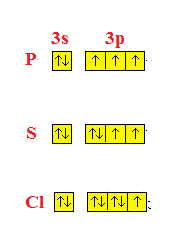
Nell’usare la rappresentazione con i quadratini bisogna considerare che gli elettroni di un atomo che appartengono ad uno stesso sottolivello, tendono ad avere spin parallelo (regola di Hund).
Vediamo alcuni esempi che tengono conto solo della configurazione più esterna, vuol dire che tutti gli orbitali precedenti sono pieni , quindi ognuno è riempito con due elettroni con spin opposto.