La legge di Gay Lussac
Lo scienziato Gay-Lussac diede un grande contributo alla scienza.
Egli fece una serie di operazioni di raffreddamento e riscaldamento dei gas a volume costante (condizione isocora), e determinò la relazione tra pressione e temperatura di un gas.
Dopo tali esperimenti arrivò ad enunciare la legge isocora o legge di Gay Lussac che affermava: a volume costante, per una determinata quantità di gas , la pressione è direttamente proporzionale alla temperatura assoluta :p\T= k.
Se a volume costante, riscaldiamo un gas , la sua temperatura passa da a
, e la sua pressione aumenta da
a
, in modo che il rapporto tra pressione e temperatura resta inalterato. Quindi possiamo anche dire:
Questa equazione ci permette di calcolare ogni singolo termine conoscendo gli altri tre.
;
;
;
Dal punto di vista cinetico accade che aumentando la temperatura aumenta la velocità delle particelle e di conseguenza aumentano gli urti, a volume costante si ha un aumento della pressione del gas.
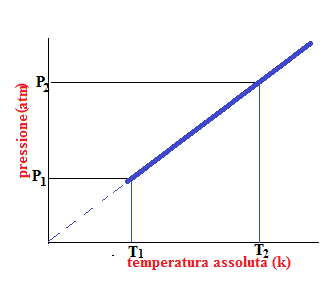
Se si riportano in un sistema di assi cartesiani i valori di pressione e temperatura, si ottiene anche in questo caso una retta, come nella legge isobara, che se prolungata incontra l’asse della temperatura a -273 °C (0 K). Anche in questo caso la relazione tra pressione e temperatura è rappresentata da una retta solo in un intervallo di temperatura. Infatti, tutti i gas passano allo stato liquido o solido prima che la temperatura raggiunga lo zero assoluto.