La maggior parte degli elementi possono forma re legami covalenti con gli elettroni liberi del livello energetico più esterno; però esistono degli elementi che hanno un comportamento particolare e cioè possono formare dei legami covalenti in numero maggiore rispetto agli elettroni disponibili (Be, B, A,l Si, C). Questo è possibile perchè tali elementi usano per formare i legami elettroni diversi da quelli dello stato fondamentale, ma derivano dagli orbitali così detti ibridi. Tali orbitali derivano dalla somma algebrica degli orbitali s,p,d,f con energia simile.
Ovviamente con la formazione degli orbitali ibridi cambia la configurazione elettronica dell’elemento, infatti capiterà che gli elettroni disponibili alla formazione di un legame non dipendono dallo stato fondamentale ma dallo stato eccitato. Capita quindi che un elettrone di un doppietto va ad occupare un orbitale vuoto con energia simile, in questo modo aumentano il numero di elettroni singoli che possono essere coinvolti in un legame.
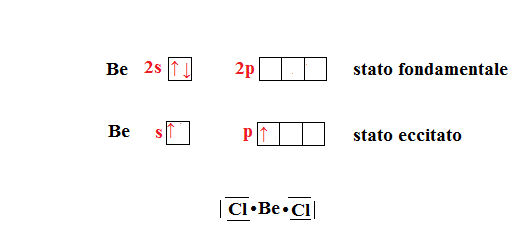
Per esempio il berilio che come configurazione esterna ha , con l’ibridazione avrà la configurazione
.
Esistono diversi tipi di ibridazione e gli orbitali ibridi hanno la stessa forma e la stessa energia.
Ibridazione sp
Tale ibridazione consiste nelle combinazione di un orbitale s con un orbitale p. Tali orbitali hanno la forma a due lobi.
Esempio di tale ibridazione è quello del berilio. Quando esso si combina con il cloro per formare esso sicuramente ha subito ibridazione; i due orbitali ibridi sp si dispongono sullo stesso piano e si orientano lungo la stessa retta, l’uno opposto all’altro. Tale disposizione è detta lineare.
Notiamo che il berilio non completa l’ottetto , infatti presenta intorno a lui solo quattro elettroni, quindi ha un ottetto incompleto.
Ibridazione 
Tale ibridazione consiste nella combinazione tra un orbitale s e due orbitali p.
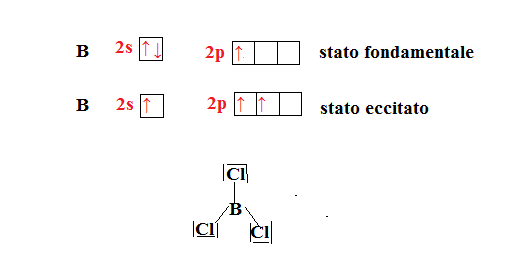
Per capire meglio consideriamo l’atomo di boro e l’unione con il cloro per formare il tricloruro di boro ().
L’atomo di boro allo stato fondamentale ha configurazione esterna . Accade che:
I tre orbitali ibridi si dispongono nello stesso piano e si orientano in direzioni dei vertici di un triangolo equilatero con disposizione planare triangolare .
Anche il boro come il berilio ha un ottetto incompleto, infatti è circondato da solo 6 elettroni.
Ibridazione 
Questo tipo d’ibridazione consiste nella combinazione tra un orbitale s e tre orbitali p.
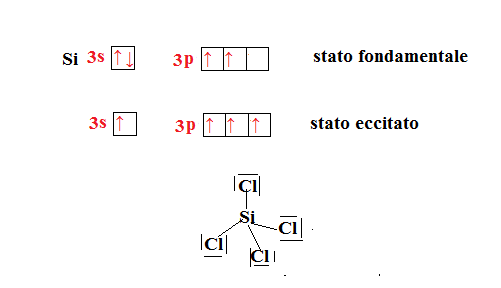
Per capirla meglio si può prendere come esempio l’atomo di silicio con configurazione esterna che si unisce con il cloro per formare
. Vediamo cosa accade.
I quattro orbitali ibridati si orientano secondo la direzione di vertici di un tetraedro, gli assi di esso formano angoli di 109,5°.
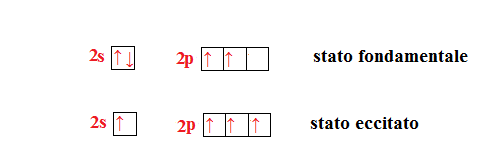
L’atomo di carbonio è particolare perchè può avere tutti i tipi di ibridazione.
Qualsiasi sia il tipo di ibridazione il carbonio ha sempre quattro elettroni liberi con i quali può formare dei legami covalenti con altri elementi. Se il carbonio è ibridato sp assume una disposizione lineare, se è ibridato ha una disposizione planare triangolare, infine con ibridazione
ha una disposizione tetraedrica..
Per riconoscere se l’atomo del carbonio è ibridato o meno basta vedere il numero di legami che esso forma; se è legato ad un solo atomo, significa che non è ibridato (CO), se è legato a due atomi è ibridato sp , se è legato a tre legami è ibridato , infine se è legato a quattro atomi è ibridato
.